Il 5 gennaio 2024, la Food and Drug Administration (FDA) ha autorizzato il programma di importazione di farmaci dell'Agenzia per l'Assistenza Sanitaria della Florida, un passo epocale verso la facilitazione dell'importazione di determinati farmaci con prescrizione direttamente dal Canada.
Importanza della Decisione FDA
Questa autorizzazione, in base alla sezione 804 del Federal Food, Drug, and Cosmetic Act (FD&C Act), segna un cambiamento significativo nel panorama della fornitura di farmaci negli Stati Uniti. Questo passo è in linea con l'Ordine Esecutivo del Presidente Biden sull'Incentivazione della Concorrenza nell'Economia Americana, che ha incaricato la FDA di collaborare con gli Stati per ridurre i costi ai consumatori senza compromettere la sicurezza pubblica.
Funzionamento del Programma di Importazione
Il programma della Florida è autorizzato per due anni dalla data in cui la FDA viene informata della prima spedizione di farmaci da importare. Prima dell'importazione, l'Agenzia per l'Assistenza Sanitaria della Florida deve sottoporre le informazioni specifiche del farmaco alla revisione e all'approvazione della FDA. Questo processo include la verifica dell'autenticità e la conformità agli standard approvati dalla FDA.
Obblighi e Monitoraggio
L'Agenzia deve anche etichettare nuovamente i farmaci in modo conforme alle direttive della FDA e presentare rapporti trimestrali all'agenzia riguardo ai farmaci importati, ai risparmi sui costi e a eventuali problemi di sicurezza e qualità. La FDA eserciterà la supervisione per garantire che il programma rispetti gli obblighi e continui a soddisfare i requisiti della sezione 804 del FD&C Act.
Dichiarazione del Commissario della FDA
Il Commissario della FDA, Robert M. Califf, M.D., ha dichiarato: "La FDA è impegnata a collaborare con gli Stati che cercano di sviluppare proposte di importazione di successo. Tali proposte devono dimostrare che i programmi comporteranno significativi risparmi ai consumatori senza aggiungere rischi di esposizione a farmaci non sicuri o inefficaci".
Prospettive Future
Stati e tribù indiane possono ora presentare proposte di programma di importazione alla FDA per revisione e autorizzazione secondo la sezione 804 del FD&C Act. La FDA ha pubblicato in precedenza una guida di domande e risposte per la conformità delle piccole imprese e ha sviluppato suggerimenti per i programmi di importazione, dimostrando il suo impegno continuo a collaborare con gli Stati interessati.
In conclusione, questa autorizzazione segna un passo importante per migliorare l'accesso ai farmaci in Florida, con potenziali impatti su scala nazionale. La FDA rimarrà vigile nell'assicurare che il programma sia attuato in conformità con gli standard più elevati, promuovendo al contempo l'obiettivo di ridurre i costi per i consumatori americani. La Florida ha aperto la strada, e il futuro potrebbe vedere ulteriori Stati aderire a questo approccio innovativo per migliorare la salute pubblica.
#FDA #Farmaci #ImportazioneFarmaci #Florida #SicurezzaSanitaria #RisparmioCosti
Informazioni Correlate: Programma di Importazione sotto la Sezione 804 del FD&C Act
Programma di Importazione sotto la Sezione 804 del FD&C Act
Il Programma di Importazione sotto la Sezione 804 del Federal Food, Drug, and Cosmetic Act (FD&C Act) è un percorso sviluppato dalla Food and Drug Administration (FDA) che consente l'importazione di determinati farmaci con prescrizione dal Canada. L'obiettivo principale di questo programma è ridurre significativamente i costi di questi farmaci per i consumatori americani, senza introdurre ulteriori rischi per la salute pubblica e la sicurezza.
La FDA è impegnata a collaborare con gli Stati e le tribù indiane che desiderano sviluppare proposte di importazione. Gli Stati e le tribù indiane hanno la possibilità di presentare proposte di programma di importazione alla FDA per revisione e autorizzazione.
Proposte del Programma di Importazione sotto la Sezione 804 (SIP)
Le proposte SIP devono fornire tutte le informazioni richieste dal FD&C Act e dai regolamenti della FDA. Il Dipartimento della Salute e dei Servizi Umani (HHS) fornisce informazioni sulla dimostrazione dei risparmi di costo per i consumatori americani. I requisiti completi sono dettagliati nei regolamenti della FDA.
In particolare, i regolamenti della FDA al 21 C.F.R. parte 251 descrivono i requisiti necessari affinché uno sponsor di un SIP dimostri che il loro programma di importazione comporterà una significativa riduzione dei costi dei farmaci con prescrizione idonei per i consumatori americani, senza alcun rischio aggiuntivo per la salute pubblica e la sicurezza. La FDA ha sviluppato una risorsa, "Tips for SIPs", che fornisce informazioni per assistere gli sponsor nello sviluppo e nell'implementazione di una proposta SIP. Una guida di conformità per piccole imprese in formato domanda e risposta è disponibile per aiutare nello sviluppo delle proposte.
Processo di Revisione della FDA
L'valutazione delle proposte SIP da parte della FDA può includere richieste di informazioni aggiuntive necessarie per garantire che la proposta soddisfi i requisiti nella legge e nella regola finale. Un esempio dell'valutazione delle proposte SIP della FDA e del potenziale processo di implementazione è rappresentato di seguito:
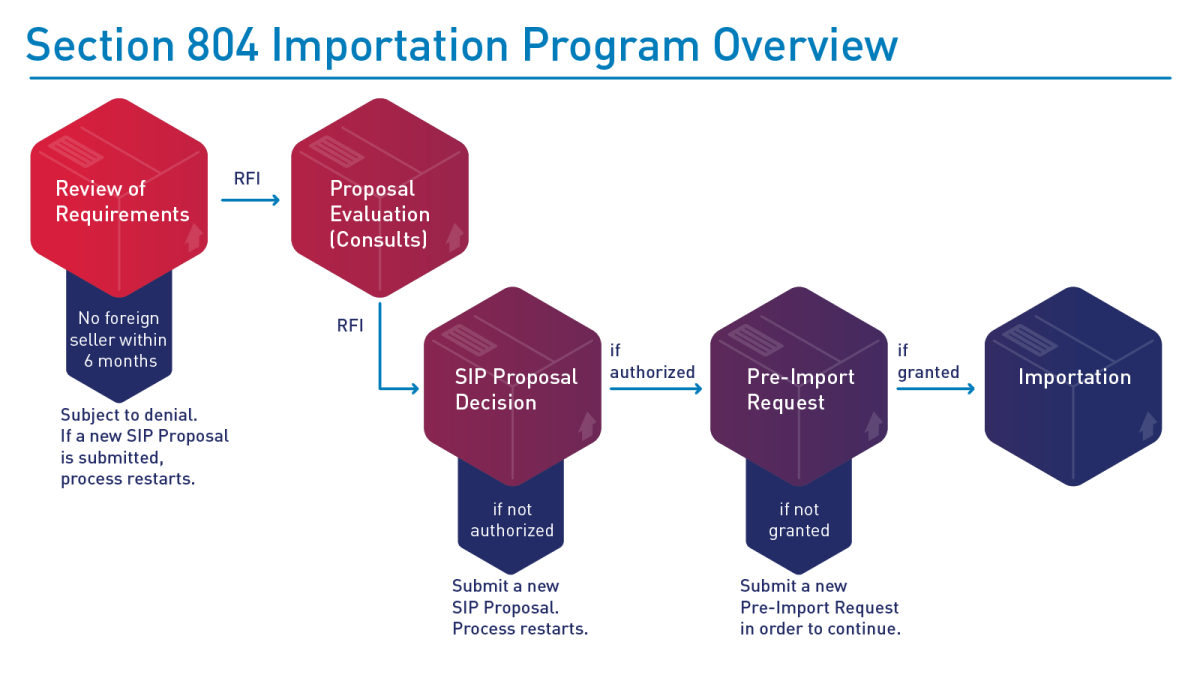
Diagramma del processo di Importazione sotto la Sezione 804
Politiche e Azioni della FDA
La FDA ha pubblicato la "Importation of Prescription Drugs Final Rule Questions and Answers; Small Entity Compliance Guide" per aiutare le piccole entità a comprendere meglio la regola finale (maggio 2022). Ha anche emesso una regola finale, "Importation of Prescription Drugs," che descrive i requisiti per i SIP e fornisce risposte della FDA ai commenti sulla proposta di regola (ottobre 2020). L'Agenzia ha incontrato rappresentanti di vari Stati e l'Accademia Nazionale per la Politica Sanitaria degli Stati per discutere lo sviluppo delle proposte SIP (marzo 2022).
Autorizzazione FDA
La FDA ha autorizzato il Programma di Importazione di Farmaci della Florida, un passo significativo verso l'attuazione di questo approccio innovativo. Gli Stati o le tribù indiane interessate possono contattare direttamente la FDA per proporre un programma o ottenere ulteriori informazioni inviando una email a: SIPDrugImportsandRFP@fda.hhs.gov. Gli Stati e le tribù indiane possono anche contattare lo Staff degli Affari Intergovernativi della FDA all'indirizzo IGA@fda.hhs.gov per iniziare la conversazione.
Questo programma rappresenta un passo avanti nella riduzione dei costi dei farmaci con prescrizione per i consumatori americani, mantenendo al contempo elevati standard di sicurezza e conformità normativa.
La FDA, un'agenzia del Dipartimento della Salute e dei Servizi Umani degli Stati Uniti, si impegna a garantire la sicurezza, l'efficacia e la sicurezza di farmaci umani e veterinari, vaccini e altri prodotti biologici per uso umano, nonché dispositivi medici. L'agenzia è anche responsabile della sicurezza e della sicurezza dell'approvvigionamento alimentare della nazione, cosmetici, integratori alimentari, prodotti elettronici emettitori di radiazioni e della regolamentazione dei prodotti del tabacco.
Glossario
- FDA (Food and Drug Administration): L'Agenzia per gli Alimenti e i Farmaci degli Stati Uniti, responsabile della sicurezza, efficacia e sicurezza di farmaci umani e veterinari, vaccini e altri prodotti biologici per uso umano, dispositivi medici, alimenti, cosmetici e tabacco.
- FD&C Act (Federal Food, Drug, and Cosmetic Act): Legge federale che regola i prodotti alimentari, i farmaci, i cosmetici e i dispositivi medici negli Stati Uniti. La Sezione 804 di questa legge è quella che disciplina il Programma di Importazione.
- Importation Program: Programma che consente l'importazione di determinati farmaci con prescrizione da un paese straniero, in questo caso dal Canada.
- Section 804 Importation Program (SIP): Programma di Importazione sotto la Sezione 804 del FD&C Act, che stabilisce i requisiti e le regole per l'importazione di farmaci con prescrizione.
- Cost Savings: Risparmi di costo per i consumatori americani derivanti dall'importazione di farmaci a prezzi più convenienti.
- Public Health and Safety: La sicurezza e la salute pubblica, che devono essere garantite durante il processo di importazione di farmaci.
- SIP Proposals: Proposte presentate dagli Stati o tribù indiane alla FDA per ottenere l'autorizzazione al Programma di Importazione.
- 21 C.F.R. part 251: Codice dei regolamenti federali, parte 251, che descrive i requisiti per dimostrare una significativa riduzione dei costi dei farmaci con prescrizione attraverso il SIP.
- Tips for SIPs: Risorse fornite dalla FDA per assistere gli sponsor nello sviluppo e nell'implementazione delle proposte SIP.
- Small Entity Compliance Guide: Guida di conformità per piccole imprese che fornisce informazioni in formato domanda e risposta per aiutare nello sviluppo delle proposte.
- HHS (Health and Human Services): Dipartimento della Salute e dei Servizi Umani degli Stati Uniti, che fornisce informazioni sulla dimostrazione dei costi per i consumatori.
- Executive Order 14036: Ordine esecutivo del Presidente Biden che promuove la concorrenza nell'economia americana, influenzando le politiche sulla riduzione dei costi dei farmaci.
- FDA Authorization: Autorizzazione della FDA per l'attuazione di programmi di importazione specifici, come il Programma di Importazione di Farmaci della Florida.
- Contact Us: Modalità attraverso cui gli Stati o le tribù indiane possono contattare la FDA per domande o presentazione di proposte SIP.













